附件:药物临床试验期间方案变更技术指导原则(试行)
附件:药物临床试验期间方案变更技术指导原则(试行)
二O二二年六月
目录
一、概述.................................................................1
二、方案变更的常见情形与评估要点...............................1
三、变更分类...........................................................3
四、安全风险评估......................................................6
五、伦理审查...........................................................7
六、变更管理与资料要求.............................................7
七、沟通交流...........................................................8
八、变更路线示意图...................................................9
九、参考文献.........................................................10
一、概述
药物临床试验期间方案变更是指药物临床试验期间,因各种原因,需要对药品审评机构已批准或经沟通交流认可的临床试验方案内容进行修改或完善。
申办者应承担临床试验方案变更的主体责任,全面、深入评估临床试验期间方案变更的必要性和科学合理性,评估方案变更对受试者安全的影响。为指导申办者更好地开展临床试验期间方案变更的安全性评估及相关工作,控制临床试验风险,保护受试者安全,制定本指导原则。
本指导原则适用于与注册相关的中药、化药、生物制品(含疫苗)相关的临床试验方案变更。本指导原则不适用于临床试验期间改变剂型、给药途径、新增适应症以及增加与其他药物联合用药等情形,上述情形不属于方案变更管理范畴,应按相关要求提出新的临床试验申请。
二、方案变更的常见情形与评估要点
(一)常见情形
药物临床试验期间,因各种原因,可能出现需要变更临床试验方案中相关内容的情形。主要包括以下几方面:
1.临床试验期间,发现药物新的安全性问题或潜在安全风险,如临床或非临床研究中新的安全性数据与信息等,需要及时对临床试验安全性研究相关内容进行修改或完善;2.临床试验期间,需要对临床试验有效性研究相关内容进行修改或完善;3.临床试验期间,为了提高临床试验实施效率,需要修改试验方案中相关内容;4.其他,如变更联系人、联系方式等,一般不涉及试验方案设计的变化。
(二)评估要点
药物临床试验期间,在方案变更前,还应全面、深入评估方案变更的必要性和科学合理性。应结合非临床安全性和有效性研究、药学工艺、质量标准、稳定性研究等,以及临床试验的不同阶段和性质,如首次人体试验、探索性试验、确证性试验等,对方案变更后临床试验的整体设计、实施、预期有效性结果、统计分析、风险控制、风险-获益权衡等重新进行评估,判断是否可能产生显著性影响,评估要点包括:
1.临床试验受试者的安全风险(包括风险-获益权衡);
2.临床试验科学性;
3.临床试验数据产生的可靠性。
三、变更分类
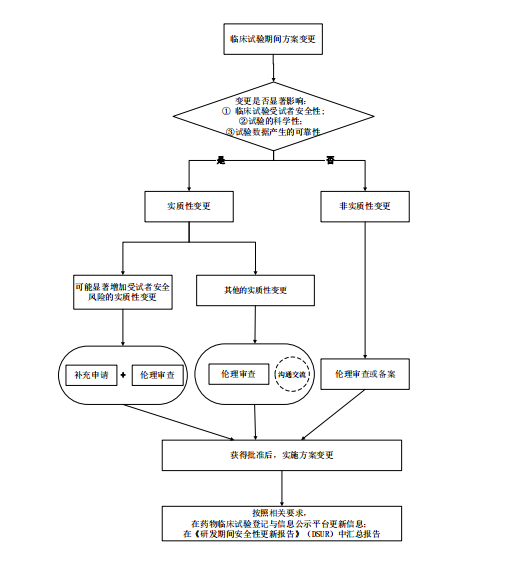
根据临床试验方案变更对受试者安全风险、试验科学性以及数据可靠性的影响程度,尤其是可能产生的不利影响,如增加受试者安全风险、降低临床试验科学性、降低临床试验数据可靠性等,可将临床试验期间方案变更分为实质性变更和非实质性变更。
(一)实质性变更
实质性变更是指对临床试验受试者的安全性、试验的科学性、试验数据的可靠性可能产生显著性影响的变更。
1.对于确证性临床试验,需要特别关注和重点评估的、可能的实质性变更举例如下:
(1)变更主要目的;
(2)变更主要终点或对试验安全性、科学性有重要影响的次要终点;
(3)变更主要终点、重要次要终点的测定方法或评价标准;
(4)变更可能对试验科学性、安全性有显著性影响的入选标准或排除标准,如明显改变受试人群特征或范围等;
(5)变更给药剂量;
(6)变更给药方法,如给药时间、给药间隔时间、给药周期等;
(7)变更、增加或删除对照组/对照药物(包括安慰剂);
(8)变更可能对试验安全性、科学性有重要影响的诊断、医疗监测方法或程序;
(9)变更可能对试验安全性、科学性有重要影响的基础治疗;
(10)减少安全性指标或访视次数或随访时间;
(11)变更试验结束的定义、暂停试验标准、终止试验标准(包括受试者个体试验终止和整个临床试验终止);
(12)变更偏倚控制方法,如随机化方法、盲法设置等;
(13)变更主要终点或重要次要终点的统计分析方法、分析计划;
(14)撤销数据安全监查委员会/数据监查委员会/独立数据监查委员会;
(15)其他。
在具体临床试验方案变更中,申办者应根据具体的试验方案设计,结合非临床及药学等相关研究结果,针对变更的具体项目、变更程度和范围进行深入分析,评估在此试验中,该变更是否确实对试验安全性、科学性或数据可靠性带来显著的不利影响,如是,则应判断为实质性变更。例如:增加给药剂量,未超出非临床安全性研究和已有临床研究结果提示的安全窗的,属于非实质性变更;已超出非临床安全性研究或已有临床研究结果提示的安全窗的,属于实质性变更。
2.对于临床药理学研究及探索性临床试验,试验性质、目的、设计与确证性试验存在较大不同,剂量、给药方案等处于探索研究过程中,因此,此阶段临床试验,实质性变更的评估重点更侧重于显著影响受试者安全风险的变更。
(二)非实质性变更
非实质性变更是指对临床试验受试者的安全性、试验的科学性、试验数据的可靠性不会产生显著性影响的变更。
在需要特别关注和重点评估的、可能的实质性变更举例中,如根据具体的临床试验方案,经综合评估后认为,变更对临床试验受试者的安全性、试验的科学性、试验数据的可靠性不会产生显著性影响,则属于非实质性变更。
其他常见非实质性变更举例如下:
1.文字打印错误;
2.文字表述的微小调整,以澄清方案中表述不明确的内容;
3.记录试验数据的文件格式或内容(非实质性内容)的适当调整;
4.变更探索性终点或其检测方法;
5.基于预防目的而不是紧急风险控制情况下增加安全性指标或访视次数(侵入性检查除外);
6.变更各相关方联系人、联系方式等;
7.其他。
四、安全风险评估
临床试验方案变更实施前,申办者应先对受试者的安全风险,以及变更试验方案的科学性等进行全面、深入的研究与评估,科学合理地判断方案变更的性质,区分实质性变更或非实质性变更。
对于实质性变更,还需进一步明确是否会显著增加临床试验受试者的安全风险。
对变更后受试者安全风险的评估,应重点围绕受试人群特征及范围、试验药物给药方案、药物暴露程度、安全剂量范围、非临床安全性研究及已知的临床安全性研究结果对目前安全性研究设计的支持程度等进行深入分析,评估方案变更后临床试验受试者安全风险是否显著增加或出现新的风险。在此基础上,结合非临床有效性研究及已知的临床有效性研究结果,进一步评估受试者预期的风险-获益。
举例如下:
删除排除标准中“肝、肾功能异常者”,但非临床安全性研究结果提示本品具有明显的肝毒性或肾毒性,综合评估认为,变更方案后的临床试验安全风险显著增加。
修订入组标准,将病情程度由“重度”修改为“轻度”,但非临床安全性研究结果和/或已知临床安全性研究结果提示本品有较大毒性反应,变更后受试者预期风险大于获益。
本指导原则中无法列举试验方案变更中安全风险评估的所有情形。申办者应结合具体情况,开展全面深入地分析和研究,科学合理地评估临床试验期间方案变更对于受试者安全风险的影响。
五、伦理审查
药物临床试验期间方案变更,在申办者充分进行风险评估的基础上,还应严格遵守伦理审查的相关规定和要求,必要时还应更新研究者手册、知情同意书等相关文件并报伦理委员会审查。
六、变更管理与资料要求
(一)方案变更实施前,除提交伦理审查外,申办者还应
根据变更的不同性质及对受试者安全风险的影响,按照以下要求开展工作:
1.对可能显著增加受试者安全风险的实质性变更,应按照《药品注册管理办法》等相关法规要求,提出补充申请。2.对其他的实质性变更(不会显著增加受试者安全风险,但可能显著影响试验科学性以及数据可靠性),若为确证性临床试验方案的变更,申办者应向药审中心提出沟通交流申请;若为其他阶段临床试验方案的变更,申办者认为必要的,可向药审中心提出沟通交流申请。3.非实质性变更,经伦理审查同意或备案后,即可实施。
(二)方案变更后,申办者还需要按照相关要求在药物临床试验登记与信息公示平台更新信息。
(三)方案变更后,申办者还应按照相关要求在《研发期间安全性更新报告》(DSUR)中汇总报告。
(四)申办者向药品审评机构提出补充申请或沟通交流申请时,至少应提供以下技术资料:
1.详细说明变更的具体内容。提供变更前、后的临床试验方案及变更事项列表对比。
2.详细说明变更的必要性、科学合理性以及受试者安全风险控制等相关的依据并提供相关研究资料。
3.必要时,还应提供非临床、药学等相关研究资料。
4.必要时/如有修订,提供知情同意书、研究者手册。5.必要时/如有修订,提供临床试验综述资料、药理毒理综述资料、药学综述资料。
七、沟通交流
对于本指导原则中未涵盖的复杂的或疑难方案变更情形,申办者在开展风险评估的基础上,可按照《药物研发与技术审评沟通交流管理办法》相关规定,向药品审评中心提出相应类别的沟通交流申请。
八、变更路线示意图
九、参考文献
1.国家市场监督管理总局.药品注册管理办法(国家市场监督管理总局令第27号).(2020-3-30)
2.CDE.关于发布《药物临床试验期间安全信息评估与管理规范(试行)》的通告(2020年第5号).(2020-7-1)
3.CDE.关于发布《药物临床试验登记与信息公示管理规范(试行)》的通告(2020年第9号).(2020-7-1)
4.CDE.关于发布《研发期间安全性更新报告管理规范(试行)》的通告(2020年第7号).(2020-7-1)
5.国家药品监督管理局.药物研发与技术审评沟通交流管理办法.(2020-12-10)
6.EMA. Detailed guidance for the request for authorization of a clinical trial on a medicinal product for human use to the competent authorities, notification of substantial amendments and declaration of the end of the trial.(2010)
7.EMA. Regulation (EU) No 536/2014 of the European Parliament and of the Council of 16 April 2014 on clinical trials on medicinal products for human use. (2014)
8.FDA.21CFR Part 312 Investigational new drug application. (2017)免责声明:本文仅是文献宣传,不具指导跟网站意见,仅供参考,具体详情请遵医嘱。
